Revue Sciences Santé | Non classé
Evaluation of the TEST-TREAT and RETAIN approach in the care continuum for people living with HIV: pilot study.
Haja RANDRIANTSARA1,2, Noëline RAZANAMIHAJA2. 1 Programme national de lutte contre les IST-SIDA 2 Ecole Doctorale Nutrition-Environnement-Santé, Université de Mahajanga, Madagascar.
Résumé : En 2017, Madagascar a initié l’approche Tester-Traiter-Retenir. L’objectif était d’évaluer l’offre de service de dépistage, la qualité des soins et de continuum auprès des personnes vivant avec le VIH, deux années après la mise en œuvre de l’approche Tester-Traiter-Retenir. Méthode: L’étude évaluative s’était déroulée dans deux centres pilotes. Une enquête était menée auprès des patients venus en consultation durant une période de 8 mois courant de l’année 2019. Les variables de l’offre de dépistage, de prise en charge, les satisfactions et difficultés rencontrées par les bénéficiaires de l’approche Tester-Traiter-Retenir étaient mesurées par le nombre et pourcentage. Résultats : 130 personnes vivant avec le VIH étaient enquêtées. L’étendu d’âge des participants était de 25 et 49 ans avec un sexe ratio de 0,46 à prédominance masculine. La proportion d’hommes (70,8 %) satisfaits du dépistage était plus élevée que celle des femmes (63,4%) mais la différence n’était pas significative (p>0,05). Les participants ayant fait des études à l’université, au lycée et en collège étaient significativement plus nombreux à déclarer être satisfaits. Concernant la qualité de la prise en charge, 42.7 % des hommes ont trouvé court le temps d’attente pour une consultation contre 29,3 % des femmes. La moitié des jeunes de 15-24 ans trouvaient que le temps d’attente était court tandis que 66,2% des 25-49 ans le trouvaient moyen (p<0,05). Quant aux coïnfections, le syphilis touchait plus les hommes que les femmes (p>0,05). Le pourcentage d’observance était significativement plus élevé chez les hommes que chez les femmes (p<0,5). La proportion d’observance augmentait avec l’âge (p<0,05). Conclusion : Les personnes bénéficiaires de l’approche Tester-Traiter-Retenir, étaient globalement satisfaites de la qualité globale de l’offre de dépistage et de la prise en charge. L’adhésion thérapeutique et l’observance au traitement n’atteignait pas encore les 90% souhaité mais semblait s’en approcher. Mots-clés : VIH, tester-traiter-retenir, stratégie, évaluation, Antananarivo, Madagascar Abstract: In 2017, Madagascar initiated the Test-Treat-Retain approach. The aim was to evaluate the provision of screening services, the quality of care and the continuum for people living with HIV, two years after the implementation of the Test-Treat-Retain approach. Method: An evaluative study was undertaken in two pilot centers. A survey was carried out among patients who came for consultation during a period of 8 months during the year 2019. Number and percentage measured the variables of the screening offer, the support, the satisfactions and difficulties encountered by the beneficiaries of the Tester approach -Process-Retain. Results: 130 people living with HIV were surveyed. The age range of the participants was 25 to 49 years old with a sex ratio of 0.46, predominantly male. The proportion of men (70.8%) satisfied with screening was higher than that of women (63.4%) but the difference was not significant (p>0.05). Participants having University students, high school students and college students were significantly more likely to report being satisfied. Concerning the quality of care, 42.7% of men found the waiting time for a consultation short compared to 29.3% of women. Half of young people aged 15-24 found the waiting time to be short while 66.2% of those aged 25-49 found it average (p<0.05). As for co-infections, syphilis affected men more than women (p>0.05). The percentage of compliance was significantly higher in men than in women (p<0.05). The proportion of compliance increased with age (p<0.05). Conclusion: People benefiting from the Test-Treat-Retain approach were generally satisfied with the overall quality of the screening offer and care. Therapeutic adherence and compliance with treatment did not yet reach the desired 90% but seemed to be approaching it.Keywords: HIV, test-treat-retain, strategy, assessment, Antananarivo, Madagascar
Comment citer cet article:RANDRIANTSARA H, RAZANAMIHAJA N. Evaluation de l’approche TESTER-TRAITER et RETENIR dans le continuum de soin de personne vivant avec le VIH : étude pilote. Revue Sci. Santé 2023; 5 :1-17
INTRODUCTION
En 2020, selon l’ONUSIDA, le nombre de personnes vivant avec le VIH (PVVIH) était estimé à 37,7 millions. Le nombre de nouvelles infections à VIH était de 1,5 millions. Le VIH/Sida a coûté la vie à 680.000 personnes. Le nombre des PVVIH sous antirétroviraux (ARV) était de 27,5 millions et 10,2 millions n’étaient pas sous traitement. Depuis le début de l’épidémie 79,3 millions de personnes ont été infectées par le VIH; 36,3 millions de personnes étaient décédées des suites de maladies liées au sida [1]. A Madagascar, la prévalence de l’infection à VIH était faible, estimée à 0,3% au niveau de la population générale âgé de 15 à 49 ans en 2020 [2], et l’épidémie était concentrée chez certains groupes de population clés, à savoir les professionnelles du sexe (PS), les hommes ayant des rapports sexuels avec les hommes (HSH) et les consommateurs de drogues injectables (CDI). Les résultats de l’étude menée par AGENCE CAPSULE/CREDES et coll., avaient montré que la prévalence du VIH chez les HSH était de l’ordre de 14,8%, de 8,4% chez les CDI et de 5,6% chez les PS [3]. Depuis la découverte du premier cas d’infection à VIH en 1987 et les deux premiers cas de Sida en 1988 et, selon la projection de l’estimation de l’infection à VIH à Madagascar (Spectrum 2021), le nombre estimé de PVVIH estimé était de 40 317 en 2020 [2], alors que le nombre de cas suivis était de 9 277 dont 8995 bénéficiaient de traitement ARV [4]. Le gouvernement malagasy s’est aligné à la Déclaration Politique de l’Assemblée Générale des Nations Unies en juin 2016 pour « accélérer la riposte au VIH afin de parvenir à l’élimination de l’épidémie du Sida à l’horizon de 2030 » qui est d’ailleurs une des composantes de l’Objectif de Développement Durable (ODD) [5]. Le Plan stratégique National de 2018-2022 reflète cette riposte multisectorielle selon les objectifs mondiaux de la lutte stipulés par l’Organisation des Nations Unies pour le SIDA (ONUSIDA) à savoir que 90% des PVVIH estimés soient diagnostiqués, 90% de ces personnes soient traitées, 90% des personnes traitées aient une charge virale indétectable ou supprimée. Des interventions prioritaires ont été orientées en lien avec cet engagement national pour avancer vers l’élimination du SIDA [6]. Parmi les interventions, il y a l’approche dite en cascade de dépistage-traitement-fidélisation soit Tester-Traiter-Retenir (TTR), qui est d‘ailleurs une recommandation de l’OMS. Elle a été adoptée à Madagascar en 2017 au moment où le nombre de PVVIH suivies était de 4181 dont 3510 bénéficiant de traitement antirétroviral (ARV) alors que le nombre total de PVVIH à Madagascar était estimé à 32 000 [7]. Cette approche vise à limiter la transmission de la maladie.
Il s’agit principalement de la déconcentration vers tous les centres de santé base de l’ensemble des soins dans le cadre de la lutte contre le SIDA facilitant l’accès au dépistage, à la prise en charge et au suivi. Tout en sachant que la suppression virale par la thérapie antirétrovirale est un élément puissant de la prévention combinée du VIH, car les personnes vivant avec le VIH et ayant une charge virale indétectable ne transmettront pas leur infection à d’autres personnes. Il importe ainsi d’évaluer la faisabilité de l’approche afin d’envisager son extension depuis les centres pilotes vers l’ensemble du pays [8]. L’objectif de cette étude était d’évaluer la mise en œuvre de l’approche TTR afin de fournir des données factuelles, des informations utiles et des recommandations pertinentes en vue de l’amélioration de l’offre de service de dépistage et de la qualité des soins de Personne Vivant avec le VIH après l’implémentation durant 2 ans dans 2 centres pilotes. II-METHODE Description de l’intervention : En avril 2017, le Ministère de la Santé par le biais du Programme National de Lutte contre les Maladies Sexuellement Transmissibles et le VIH/SIDA, avait mis en œuvre l’approche « Tester-Traiter-Retenir » (TTR) dans deux centres pilotes. Cette approche appartient à l’initiative de l’OMS pour accélérer la riposte au VIH/SIDA par l’élargissement de l’intervalle des critères afin d’accroître le nombre de personnes éligibles au traitement. Se basant sur cette approche, toute personne dépistée positive serait éligible directement au traitement quel que soit son taux de lymphocytes CD4. [9]. Avant l’approche TTR, le continuum de soins sur le VIH s’effectuait selon un circuit bien défini. Le premier test de dépistage (T1) se réalisait d’abord auprès des centres de santé de base, publiques ou privés, disposant de kits pour le test T1, fournis par le Ministère de la Santé via le Programme National de Lutte contre le SIDA. Le patient réactif au test T1 va ensuite être orienté vers un centre d’éclatement où il bénéficie des tests T2 et T3 qui sont des tests de confirmation de la séropositivité [10]. Les deux centres pilotes pour l’implémentation de l’approche TTR ont été des auparavant des centres d’éclatement situés à la capitale, Antananarivo au Bureau Municipal d’Hygiène (BMH) Isotry et au dispensaire SISAL 67 Ha. À l’issue de ces séries de tests (T1, T2, T3), le patient dépisté séropositif au VIH était orienté vers un médecin référent (travaillant au centre hospitalier universitaire de Befelatanana, Antananarivo) qui est également le responsable de la suite de la prise en charge dès le counseling, passant par les examens cliniques et para cliniques, jusqu’à la prescription et le suivi du traitement. La mise sous traitement antirétroviral des PVVIH est volontaire et elle devrait être institué à partir d’un taux de CD4 inférieur à 500 par millimètre cube. Les patients avec un taux supérieur à ce seuil bénéficiait d’un suivi régulier clinique et para clinique et pourraient devenir éligibles ultérieurement. Ce circuit complexe de prise en charge entraine souvent un nombre important de perdus de vue parmi les PVVIH qui sont déjà exposées à des stigmatisations et discriminations du fait de la connotation négative liée à cette pathologie [11]. Dans l’approche TTR, l’ensemble des étapes est effectué dans un seul centre depuis le dépistage jusqu’au traitement et le suivi. Lors de sa future mise à l’échelle à travers l’ensemble du pays, toute PVVIH va pouvoir recevoir l’ensemble des soins nécessaires auprès d’un même centre depuis le dépistage jusqu’au suivi du traitement. Tout d’abord, le personnel de ces centres pilotes avait bénéficié d’une formation donnée par l’équipe du Programme National de Lutte contre le SIDA afin qu’ils aient la compétence nécessaire d’assurer l’ensemble de la prise en charge. Ensuite, les infrastructures ont été aménagées pour permettre la prise en charge des PVVIH en vue d’assurer l’anonymat et la confidentialité de chaque patient lors de la consultation. À la fin, après la dotation des deux dispensaires (BMH Isotry et cabinet SISAL) en matériels nécessaires (réactifs pour le test de dépistage et médicaments antirétroviraux), ils étaient devenus des centres pilotes pour tester l’approche TTR depuis Avril 2017 [12].
Évaluation et analyse Il s’agissait d’une étude de processus et d’effet qui visait à évaluer la mise en œuvre de l’approche TTR. L’évaluation du processus était appréciée par les signes d’amélioration de l’offre de dépistage et les éléments de satisfaction ainsi que des difficultés rencontrées par les bénéficiaires en liaison avec le continuum de soins. L’évaluation de l’effet dans la présente étude était estimée à partir de l’observance et de l’adhésion thérapeutique des PVVIH bénéficiaires de l’approche TTR. L’étude se déroulait dans deux centres qui prenaient en charge les PVVIH dans la capitale, Antananarivo. Ces centres recevaient habituellement une concentration importante de personnes à risque: les professionnels de sexe et les hommes ayant des rapports sexuels avec les hommes. On a ainsi procédé à une enquête auprès des patients venus en consultation durant une période de 8 mois au courant de l’année 2019. L’échantillonnage exhaustif était appliqué. Tous les consultants, d’âge supérieur à 15 ans étaient inclus dans l’échantillon sous réserve qu’ils consentaient à participer à l’enquête. Au total, la taille de l’échantillon finale répondant à nos critères et ayant accepté de participer à l’étude était de 130 PVVIH fréquentant les deux centres pilotes.
Variables Dans le cadre de l’évaluation de processus, on a évalué les variables de l’offre de dépistage et de la prise en charge ainsi que les satisfactions et les difficultés rencontrées par les bénéficiaires liés à leur continuum de soins. En ce qui concerne l’évaluation d’effet, l’observance et l’adhésion thérapeutique ainsi que les problèmes au cours du suivi du traitement faisaient partie des variables étudiées. L’observance au traitement se traduisait, pour un patient sous antirétroviral, par l’absence d’interruption au cours des 3 derniers mois. Ces caractéristiques étaient mesurées par le nombre ou pourcentage de PVVIH qui bénéficiait de services liés au VIH tout au long du continuum de soins, et par le nombre et pourcentage de PVVIH satisfaits ou non, appréciant ou pas les différentes offres et services de santé en liaison avec l’approche TTR.
Analyse statistique : Le logiciel d’analyse SPSS 20.0 était utilisé pour le traitement et l’analyse des données. Le pourcentage et les mesures de tendances centrales étaient utilisés pour les analyses unies variées en décrivant les caractéristiques sociodémographiques et économiques des PVVIH. Pour l’analyse bi variée, des comparaisons étaient menées avec le test de Chi-deux de Pearson avec un intervalle de confiance de 95%. Le seuil de signification a été fixé pour un p < 0,05.
Considérations éthiques : Le protocole d’étude a été présenté et a reçu l’approbation du comité d’éthique pour la recherche biomédicale à Madagascar (CRBM) selon l’autorisation N° 30- MSANP/SG/AGMED/CNPV/CERBM du 17 mai 2019. Avant chaque entretien, le consentement du participant était requis. Comme il s’agissait d’une maladie qui reste encore stigmatisant, et en tenant compte de la participation volontaire à l’enquête, nous avons proposé la possibilité de répondre ou ne pas répondre aux questions parmi les PVVIH recrutées. Ainsi, le nombre de répondants pourrait ne pas être le même pour chaque variable.
III- RESULTATS
- Description de l’échantillon
Le Tableau 1 présente les caractéristiques sociodémographiques des participants. Ainsi, 130 PVVIH ont été enquêtées et le sexe ratio était de 0,46 avec une prédominance masculine. L’âge moyen des patients était de 27 ans avec un écart type de ±0,56. La moitié (50 %) appartenait à la catégorie d’âge entre 25 et 49 ans. La tranche d’âge de 15 à 24 ans était de l’ordre de 46,2%. Seulement, 3,8% d’entre étaient âgés de 50 ans et plus. La majorité des sujets répondants soit 86,1% vivaient seuls avec 60,8% de célibataires, 13,5% en union libre et 11,5% divorcés. La majorité des participants étaient des homosexuels à 46,9 %, les hétérosexuels à 33.8% et bisexuels à 19,2 %. En ce qui concerne le niveau d’éducation, 33,8% ont fait l’enseignement secondaire et 20% ont arrêté leur étude au niveau primaire et 17,7% d’entre eux ont affirmé être des étudiants. Quant à leur occupation, 42,3% gagnaient leur vie avec des petits commerces et 15,4% ont affirmé leur statut de professionnel de sexe et 17,7% étaient des étudiants. Concernant leur revenu mensuel, 74,6% recevaient un montant inférieur à 200.000 Ariary par mois soit environ 40euros et 63,8% avaient en moyenne une à deux personnes en charge.
Tableau 1 : Distribution des sujets d’étude selon les caractéristiques sociodémographiques et économique (n=130)
b. Résultats de l’évaluation du processus
- Résultat de l’offre de service de dépistage
Les caractéristiques de l’offre de dépistage sont présentées dans le Tableau 2. Temps d’attente des résultats du test de dépistage : D’après les résultats, 67,7 % des répondants avaient déclaré avoir appris les résultats des tests en moins de 30 minutes, dont, en moins de 10minutes, pour 28,5% d’entre eux. Tandis que, le temps d’attente pour la prise en charge a duré moins de 10mn pour 28,5% des PVVIH interrogées et entre 30mn et 1heure pour 22,3% des participants. Pour le temps d’attente après la découverte du résultat pour la prise en charge, 40 % des répondants ont déclaré qu’ils se sont écoulés entre 10 et 30 minutes, avant d’être reçu par un médecin en vue d’une prise en charge. Pour 25,4 % des participants, ce temps d’attente était de moins de 10 minutes. La première prise de contact avec le médecin s’était déroulée le même jour après la remise des résultats selon la déclaration de 83,8% des répondants et après quelques jours voir même après quelques semaines pour 11,5% et 3,1% des répondants respectivement.

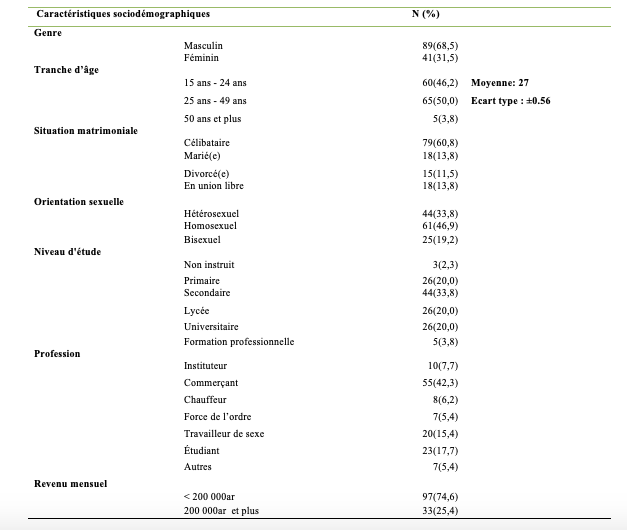
Les résultats de l’évaluation de la qualité de l’offre de dépistage, en fonction du genre, de la tranche d’âge, de leur orientation sexuelle ainsi que leur niveau d’éducation sont présentés dans le Tableau 3.
Globalement, 68,5% des répondants avaient rapporté que l’offre de service était satisfaisante mais la proportion de répondants satisfaits variait selon le genre. Ainsi, la proportion d’hommes satisfaits de l’offre de service était plus élevée (70,8 %) que celle des femmes (63,4%) mais la différence n’était pas significative (p>0,05). En fonction du groupe d’âge, l’analyse a montré que le pourcentage de satisfaits augmentait avec l’âge: 66,7 % chez les 15 à 24 ans, 67,7 % chez les 25 à 49 ans et 100 % des plus de 50 ans sans différence significative (p>0,05). En fonction de l’orientation sexuelle, les résultats ont montré que la proportion de satisfaits de l’offre de service de dépistage semblait significativement différente. A 73%, les homosexuels étaient le plus nombreux à être satisfaits contre 65,9% pour les hétérosexuels et la différence était statistiquement significative (p<0,05). En fonction du niveau d’étude achevé, les universitaires, les lycéens et ceux qui ont arrêté leurs études au niveau des collèges étaient significativement plus nombreux à déclarer être satisfaits(73,1% à 84,6% respectivement) par rapport aux non instruits et à ceux qui ont arrêté leur étude au niveau primaire 33.3% à 42,3% respectivement (p<0,05).
Tableau 3 : Proportion de satisfaits de la qualité de l’offre de dépistage en fonction du genre, de la tranche d’âge, de l’orientation sexuelle et du niveau d’éducation (n=130)
- Résultats de l’évaluation de la qualité de la prise en charge
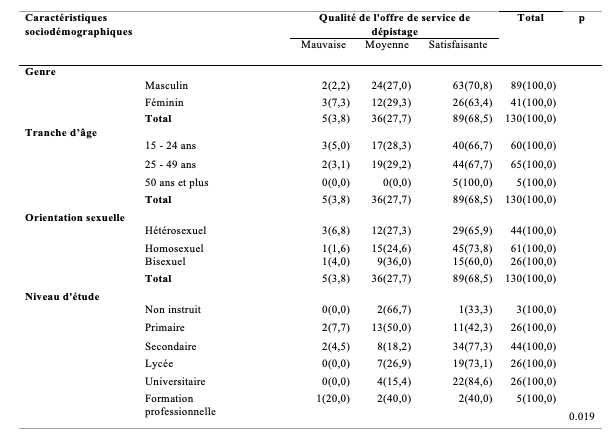
Le Tableau 4 montre la répartition des PVVIH selon leur perception du temps d’attente de consultation en fonction du genre, de l’âge et du niveau d’étude. Ainsi, chez les hommes, 42,7% avaient déclaré trouver le temps d’attente court pour une consultation contre 29,3 % des femmes. Effectivement, les femmes à 12,2% étaient plus nombreuses à revendiquer que le temps d’attente de consultation était long, comparées aux hommes (7,9%). La différence était significative (p<0,05). Concernant le temps d’attente de consultation en fonction du groupe d’âge, la moitié des jeunes de 15-24 ans ont trouvé que l’attente était courte contre 66,2% des 25-49 ans qui ont trouvé que le temps d’attente était moyen. Pour les 50 ans et plus, 60,0% avait trouvé ce temps d’attente de prise en charge était moyen (ni long ni court). La différence était statistiquement significative (p<0,05). Par rapport au niveau d’étude suivie, les non instruits à 66,7% avaient trouvé que le temps d’attente était court alors que 61,5% des universitaires ont rapporté que le temps d’attente était moyen. Mais la différence n’était pas significative (p>0,05).
Tableau 4 : Répartition des PVVIH selon la perception de la durée de consultation en fonction du genre, de l’âge et du niveau d’étude (n=130)
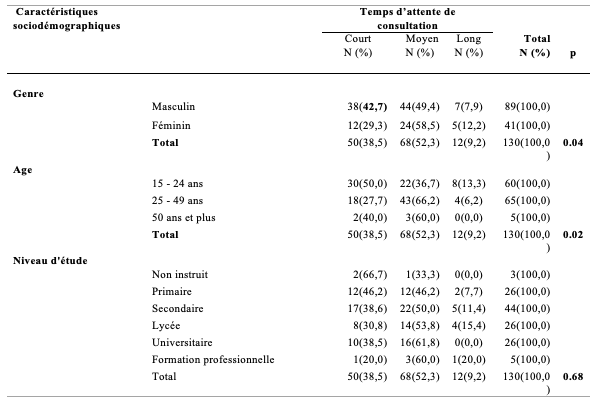
Le tableau 5 donne la distribution des PVVIH en fonction de leur perception de la durée de consultation selon le genre, la tranche d’âge et l’orientation sexuelle. Quarante six pourcent des hommes ont trouvé la durée de consultation convenable contre 29,3% des femmes; 43,9 % des femmes contre 36,0% des hommes l’ont trouvée moyenne et près de 27% des femmes contre 18% des hommes avaient trouvé que le temps de consultation était trop vite. Mais ces différences n’étaient pas significatives (p>0,05). Globalement, pour 40,8% des répondants, la durée de consultation était convenable ; moyenne pour 38,5% et trop vite pour 20,8%. La majorité des répondants, indifféremment de la tranche d’âge, avait rapporté que la durée de consultation leur convenait. Mais en général, les plus jeunes (15-24ans) étaient plus nombreux (26,7 %) à trouver cette durée trop courte, comparés aux 25 – 49 ans (16,9%) mais la différence n’était pas statistiquement significative (p>0,05). Tandis que les plus de 25 ans étaient les plus nombreux à rapporter que la durée de consultation leur convenait, ou bien ils la trouvaient moyenne. En fonction de leur orientation sexuelle, 50,8% des homosexuelles ont trouvé que la durée de la consultation était convenable contre 36,4% des hétérosexuels et 24.0% des bisexuels. La différence était significative (p<0,05).
Tableau 5 : Nombre et pourcentage de PVVIH satisfaits ou non de la durée de la consultation en fonction du genre, de l’âge et de l’orientation sexuelle
c. Résultats de l’évaluation d’effet :
- Résultats sur l’observance au traitement
par les PVVIH
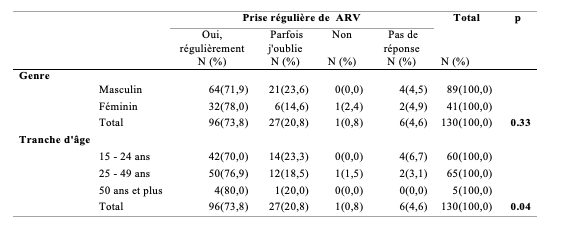
Le Tableau 6 montre la proportion de PVVIH ayant respecté l’observance au traitement en fonction du genre et de la tranche d’âge. L’observance était plus élevée chez les femmes (78,0%) que chez les hommes (71,9%). Mais la différence n’était pas significative (p>0,05). La fréquence de l’observance augmentait avec l’âge car elle était de 70% pour la tranche d’âge de 15 à 24 ans, 76,9% pour les 25-49 ans et 80% pour les 50 ans et plus et la différence était significative (p<0,05). L’observance globale (Prise régulière d’ AntiRetroViral (ARV) ou AntiRetroviral Therapy (ART) était de 73,8%.
Tableau 6 : Proportion d’observance des PVVIH et de prise régulière du Traitement AntiRetroViral (ARV) en fonction du genre et de la tranche d’âge (n=130)
DISCUSSION Les processus de l‘évaluation de l’approche TTR dans l’offre de dépistage et de la prise en charge étaient évalué dans la présente étude par trois variables : le temps d’attente de résultat, le temps d’attente de prise en charge post découverte et le temps de la première prise de contact avec le médecin référent. L’analyse des données avait identifié que, près des deux tiers des répondants avaient trouvé que le temps d’attente de résultat est inférieur à 30 minutes. Un temps d’attente des résultats court, est le reflet de la qualité de dépistage. Par rapport à l’algorithme de dépistage national et la complexité du circuit de client pour le dépistage, ce temps est satisfaisant. Dans la présente étude, le délai de rendu des résultats se fait le même jour pour 83,8% des sites TTR. L’enquête, menée par le projet l’Agence International de Coopération Japonaise (JICA/VIH) en 2012 à Madagascar sur les activités de counseling et dépistage, a montré que le délai de rendu des résultats se faisait le même jour pour 95,41% des sites non TTR avec un délai moyen de 3 heures et un délai maximum de 3 jours [13]. Par contre l’Association médicale et humanitaire « Médecins du monde » dans son enquête concernant la qualité de dépistage à Madagascar en 2017, avait trouvé un résultat comparable stipulant qu’un dépistage idéal est vite fait rapporté par 53,2% des répondants pour les sites non TTR [14]. La revue systématique de littérature menée par Laprise C et coll., au Canada de 2009 à 2019, avait identifié ces facteurs temps d’attente comme étant des facteurs pouvant être favorables ou obstacles au dépistage du VIH [15]. Duffus et coll. [16], ainsi que les auteurs de l’étude Opportunités [17], les avaient relatées également rapportés dans leurs études. Vony Soa et coll., avaient rapporté, dans leur recherche opérationnelle que la complexité du circuit de dépistage en liaison avec le délai des rendus des résultats, figurent parmi les facteurs déterminants de la découverte tardive de VIH à Madagascar [13]. Le temps d’attente de prise en charge post découverte, était inférieur à 30 minutes selon la déclaration des deux tiers des répondants. Ces derniers avaient rapporté qu’ils étaient reçus par le médecin référent le jour même après la remise des résultats. La présente étude a montré qu’il existe un lien entre le service de dépistage et le service de prise en charge. Wandwalo E et al., [18] dans une étude expérimentale menée dans cinq pays (Bénin, Cambodge, Kenya, Malawi et Rwanda) ont conclu qu’il est important de mettre un lien entre le service du dépistage et le service de prise en charge en appelant ainsi le service totalement intégré. En effet, les services indépendants engendrent une perte de temps pour les patients et entrainent des coûts indirects pour ces derniers. Cette situation rend les patients inconfortables car ils doivent expliquer à nouveau leurs problèmes à un autre conseiller. Dans les pays à ressources limitées, principalement en Afrique sub-saharienne, on estime que 40 % des personnes diagnostiquées ne sont pas mises en relation avec des services de soins [19, 20] et le TAR est souvent commencé tardivement [21]. Les revues systématiques menées par Govindasamy et al., et par Johnson C et al., ont relaté que les facteurs pouvant contribuer à une mauvaise liaison et en particulier à de faibles taux d’accès aux soins et au traitement après un dépistage de VIH, sont de natures diverses : obstacles au sein du système de santé, (mauvaises orientations), obstacles au sein des services (stigmatisation, services peu accueillants ; temps d’attente trop longs) [22, 23]. On peut dire qu’en absence de lien entre les services de traitement et de soins, le dépistage et la connaissance du statut VIH-positif, ont un intérêt limité. La satisfaction des PVVIH bénéficiant l’approche TTR s’appréciait par la satisfaction globale de l’offre de dépistage et de la prise en charge. Le concept de satisfaction exploré est rarement défini de façon explicite. On s’accorde pour identifier une satisfaction « rapportée » par les patients qui peuvent « juger » de la « qualité des prestations et des soins ». Dans la présente étude, la satisfaction de l’ensemble de l’offre de dépistage était croisée par d’autres variables. Ainsi, il était constaté que la satisfaction dépendait du niveau d’étude mais pas de l’âge ni de l’orientation sexuelle. Pour l’offre de service de prise en charge, plus des deux tiers des PVVIH pris en charge dans les sites TTR étaient satisfaits de l’ensemble de la prise en charge. Les éléments qui ont satisfait le plus étaient l’accueil et la disponibilité des médicaments. Par contre, seul un pourcentage restreint de répondants était satisfait de la salle d’attente et de la présence des stagiaires Quoi qu’il en soit, ces résultats traduisaient une certaine amélioration, comparés à ceux de l’étude de Njatosoa Fiadanana et al. Ces derniers avaient trouvé que 17.5% seulement des PVVIH étaient satisfaits de l’offre de soins dans les centres de référence. Par ailleurs, la salle d’attente et la récupération des médicaments auprès des dispensateurs étaient considérés comme des éléments les plus dérangeants pour les PVVIH des centres de référence. Notons qu’une diminution progressive au cours du temps de taux de satisfaction a été observée [25]. L’évaluation de l‘effet de l’approche TTR sur l’adhésion thérapeutique et l’observance des PVVIH s’estimait par le respect du rendez-vous avec leur médecin et la prise régulière de l’ARV. Concernant l’adhésion thérapeutique, près de 70% des patients ont respecté la date du prochain rendez-vous avec leur médecin traitant pour la consultation de suivi et la récupération de leur ARV. Les facteurs influençant l’adhésion au traitement étaient la discrétion, le problème alimentaire et le problème financier. Sur cet optique, plus des deux tiers des répondants ont évoqué qu’ils n’ont pas aperçu des gestes discriminatoires envers eux. Cependant, près du tiers d’entre eux étaient plutôt méfiants envers les stagiaires, les filles de salle et les réceptionnistes pour divulguer leurs statuts sérologiques ou des informations personnelles qui les concernaient. Bref, ils n’avaient pas confiance, les trouvaient trop curieux, et pas discrets.
De même, 73,80 % ont été observant au traitement antirétroviral en prenant régulièrement leur traitement. Lors de l’étude de cohorte APROCO menée par Carrieri P, les auteurs ont montré que l’observance est un processus dynamique, la majorité des patients avait un comportement d’observance variable au cours du temps [26]. Après 20 mois de suivi, seul 31 % des patients ont maintenu une observance élevée tout au long du suivi, alors que la majorité des patients (52 %) ont présenté une observance élevée à certains suivis seulement. De même, Boullé C et al., dans leur étude a déclaré que 38 % des patients avaient eu une intolérance à l’ARV source de non observance au traitement [27]. Spire B et al. , ont parlé dans leur étude que l’âge jeune, la consommation élevée d’alcool, les difficultés sociales, la dépression étaient très souvent corrélés à des comportements de non-observance, ils ne constituaient pas non plus à eux seuls de bons marqueurs prédictifs de l’observance [28]. En revanche Moatti JP etal. , ont exprimé d’autres facteurs positivement associés à une moins bonne observance dans leur étude de l’impact non prédictible du vécu des traitements tels que le sentiment d’une dégradation de l’état de santé, la persistance d’un état de dépression, l’absence de confiance envers son médecin ainsi qu’une mauvaise perception du rôle des thérapeutiques au cours du traitement [29]. Ainsi, l’approche TTR a une influence sur l’observance et l’adhésion thérapeutique des PVVIH mais les résultats sont très subjectifs d’un patient à un autre. Limites de l’étude L’étude a été menée au niveau de deux centres pilotes et l’échantillonnage n’était pas aléatoire et les résultats obtenus peuvent ne pas être généralisables à Madagascar toute entière vu le contexte anthropologique et socio-économique de chaque Région. Comme il s’agissait d’une étude évaluant une stratégie appliquée, la principale limite de cette étude pourrait être le biais de mémorisation. Les PVVIH enquêtées pourraient ne pas se rappeler des informations sur les circonstances antérieures d’une manière concise.
Suggestions pour la recherche future L’étude avant-après bien menée, comparant la situation avant et après la mise en œuvre du TTR représente un des designs d’étude les plus indiqués pour une évaluation de processus. Etant la base de la stratégie appliquée dans l’élimination de l’épidémie de Sida en tant que menace pour la santé publique en 2030 et, après avoir évalué la mise en œuvre de l’approche TTR, nous apportons des suggestions en vue de l’amélioration du continuum de soins. Nous suggérons de mettre fin à l’exceptionnalisme du dépistage du VIH et à la stigmatisation de l’infection elle-même ainsi que l’absence du lien avec le service de prise en charge. Nous suggérons à l’égard :
a) du dépistage:
- Intensification du dépistage ciblé selon l’évidence du VIH. Cette intensification passe par des critères d’indications de dépistage plus inclusifs, par un dépistage plus fréquent et par l’allègement du processus de dépistage en utilisant éventuellement les nouveaux outils de dépistage (Communautaire, TROD, CDIS, auto dépistage,…)
- Implantation de différentes stratégies innovantes adaptées aux réalités locales, régionales, et aux populations visées (PREP, PTME, DIC, Index Testing)
- Offre universelle de dépistage une fois dans sa vie à toute personne entre 18 et 65 ans.
b) la prise en charge il est recommandé, pour Madagascar, d’insister sur:
- l’importance du soin humanisant (l’accueil du personnel et l’espace d’accueil, relation patient-médecin)
- la vulgarisation de la délégation des tâches (infirmier, sage femmes, médiateurs) pour le traitement ARV
- l’intégration de service spécialisé supplémentaire au paquet minimum de soin (Hépatite, Tuberculose, Gynécologie et Dermatologie)
- le système d’information stratégique reposant sur la surveillance et des données programmatiques est nécessaire pour orienter le changement dans les politiques et la mise en œuvre.
- la dotation et la mise en place des dispositifs pour une charge virale opérationnelle.
Conclusion Cette recherche à visée évaluative a pu mettre en exergue l’influence de l’approche TTR dans l’offre de service de dépistage et de la prise en charge. Par ailleurs, nous pouvons apprécier les satisfactions de PVVIH bénéficiaires de l’approche TTR par rapport à la qualité globale de l’offre de dépistage et de la prise en charge. De même, nous avons pu estimer l’adhésion thérapeutique et l’observance au traitement de PVVIH bénéficiant de cette approche. Des hypothèses qui méritent d’être approfondies ont émergé de cette évaluation. Force est de constater l’importance de renforcement de l’amélioration du continuum de soins du PVVIH et inévitablement de mettre fin à l’exceptionnalisme du dépistage du VIH et à la stigmatisation de l’infection elle-même et l’absence du lien avec le service de prise en charge. En fin, des suggestions ont été apportées et plusieurs études devront être menées non seulement au niveau du système de santé mais aussi au niveau communautaire. En perspective, une étude sur l’enjeu et la place de la délégation des tâches dans la lutte contre le VIH/Sida devrait être faite en complémentarité de cette étude pour appréhender l’impact de cette stratégie TTR dans le continuum de soins de PVVIH et afin de prendre plus de décision en vue de l’élimination de l’épidémie de Sida en tant que menace pour la santé publique en 2030. Remerciements : Nous adressons nos vifs remerciements à tous ceux qui ont contribué de près ou de loin à la réalisation de l’étude. Conflits d’intérêts : pas de conflit déclaré RÉFÉRENCES BIBLIOGRAPHIQUES
- Rapport mondial actualisé sur le sida 2021/ ONUSIDA 2021 – WORLD AIDS DAY 2021(internet)
- Résultat de modélisation de logiciel Spectrum 2021, ONUSIDA Madagascar SE/CNLS
- AGENCE CAPSULE/CREDES en collaboration avec le Service de Laboratoire National de Référence. Etude de surveillance biologique et comportementale du VIH et de la syphilis chez les professionnelles du sexe à Madagascar (ESBC Professionnelles du Sexe, 2016) ESBC PS et HSH 2016, ESBC CDI 2017
- Rapport Cohorte de PVVIH au niveau de centre de référence de PNLIS, 2021.
- 90–90–90. Ambitious treatment targets: writing the final chapter of the AIDS epidemic – a discussion paper. Geneva: Joint United Nations Programme on HIV/AIDS; 2014 (http://www.unaids.org/en/resources/ documents/2014/90–90–90, accessed 3 March 2015).
- Résolution 70/1 de l’Assemblée générale des Nations Unies – Transformer notre monde : le Programme de développement durable à l’horizon 2030.
- Groupe Technique de Suivi Evaluation, Forum des partenaires. Global Aids Monitoring 2018, Rapport mondial d’avancement sur la lutte contre le sida, mars 2018
- Cohen MS, Chen YQ, McCauley M, Gamble T, Hosseinipour MC, Kumarasamy N et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med. 2011;365(6):493-505.
- WHO. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach. 2013. [Cited 01/10/2014].Available from: http://apps.who.int/iris/bitstream/10665/85321/1/9789241505727_eng.pdf
- Normes et procédures de counseling et dépistage à Madagascar, édition 2011
- Kinsler JJ, Wong MD, Sayles JN, Davis C, et al. The effect of perceived stigma from a health care provider on access to care among a low-income HIV-positive population. AIDS Patient Care STDS 2007; 21(8): 584-92.
- Lettre d’information DLIS N°214/MNSAP/SG/DGS/DLIS du 05 avril 2017
- Vony Soa HHJ, Rakotoarivelo RA., Rakotomanana AH et al. Facteurs déterminants la découverte au stade tardif de l’infection à VIH à Madagascar, 2012. In :Rapport final des recherches opérationnelles Mars 2012. MinSan, JICA. Accessible sur https://www.jica.go.jp/Resource/madagascar/french/office/others/pdf/publications02_22.pdf
- Médecin du Monde. Rapport scientifique de l’observatoire sur le parcours de soins VIH parmi les populations clés et les Pvvih d’Antananarivo, Mahajanga, Toamasina, Antsiranana et Toliara 2017-2019. Enquête n°2 qualité de dépistage
- Laprise C, Bolster-Foucault C. Comprendre les obstacles et les facteurs favorables au dépistage du VIH au Canada de 2009 à 2019 : examen systématique des études mixtes. Relevé des maladies transmissibles au Canada 2021;47(2):117–38. https://doi.org/10.14745/ccdr.v47i02a03f
- Duffus WA, et al. Risk-based HIV testing in South Carolina health care settings failed to identify the majority of infected individuals. AIDS Patient Care STDS 2009; 23(5): 339-45.
- Champenois K, Cousien A, Cuzin L et al. Missed opportunities for HIV testing in newly-HIV-diagnosed patients, a cross sectional study. BMC Infect. Dis. 2 mai 2013; 13(1) : 200
- Wandwalo E et al. Meilleures pratiques en matière d’intégration des services de soins TB et VIH/Sida Expérience de cinq pays Bénin, Cambodge, Kenya, Malawi et Rwanda.2010.
- Rosen S, Fox MP. Retention in HIV care between testing and treatment in sub-Saharan Africa: a systematic review. PLoS Med. 2011;8(7):e1001056.
- Kranzer K, Govindasamy D, Ford N, Johnston V, Lawn SD. Quantifying and addressing losses along the continuum of care for people living with HIV infection in sub-Saharan Africa: a systematic review. J Int AIDS Soc. 2012;15(2):17383
- Siedner MJ, Ng CK, Bassett IV, Katz IT, Bangsberg DR, Tsai AC. Trends in CD4 count at presentation to care and treatment initiation in sub-Saharan Africa, 2002-2013: a meta-analysis. Clin Infect Dis. 2015;60(7):1120-7.
- Govindasamy D, Ford N, Kranzer K. Risk factors, barriers and facilitators for linkage to antiretroviral therapy care: a systematic review. AIDS. 2012;26(16):2059-67. 66.
- Johnson C, Wong V, Baggaley R, Thaddeus S, Brown C. Three delays and linkage to care: a systematic review of barriers affecting initial enrolment in care among HIV diagnosed persons. Paper presented at: International Conference on AIDS and STIs in Africa. 2013 December: 7-11; Cape Town, South Africa.
- HIV test-treat-retain cascade analysis: guide and tools. Cairo: WHO Regional Office for the Eastern Mediterranean.2014. (http://applications.emro.who.int/dsaf/EMROPUB_2014_EN_1639.pdf?ua=1, accessed 21 March 2015).
- Médecin du Monde. Rapport scientifique de l’observatoire sur le parcours de soins VIH parmi les populations clés et les PVVIH d’Antananarivo, Mahajanga, Toamasina, Antsiranana et Toliara 2017-2019. Enquête n˚3 : qualité de la prise en charge du VIH et ses effets sur l’adhésion au traitement à Madagascar
- Carrieri P, Cailleton V, Le Moing V, et al. The dynamic of adherence to highly active antiretroviral therapy: results from the French National APROCO cohort. J Acquir Immune Defic Syndr 2001 ;28:232-239.
- Boullé C, Kouanfack C, Laborde-Balen G, Boyer S, Aghokeng AF, Carrieri MP, Kazé S, Dontsop M, Mben JM, Koulla-Shiro S, Peytavin G, Spire B, Delaporte E, Laurent C. 2014. Gender differences in adherence and response to antiretroviral treatment in the Stratall trial in rural disctrict hospitals in Cameroon. Under review in Journal of Acquired Immune Deficiency Syndrome
- Spire B, Duran S, Souville M, Leport C, Raffi F, Moatti J P « Adherence to highly active antiretroviral therapies (HAART) in HIV-infected patients : from a predictive to a dynamic approach ». Soc Sci Med 2002; 54 : 1481-1496
- Moatti JP, Carrieri MP, Spire B, Gastaut JA, Cassuto J. P., Moreau J. « Adherence to HAART in French HIV-infected injecting drug users: the contribution of buprenorphine drug maintenance treatment. The Manif 2000 study group ». AIDS 2000, 14 : 151- 155
